治験・臨床研究を学ぶ
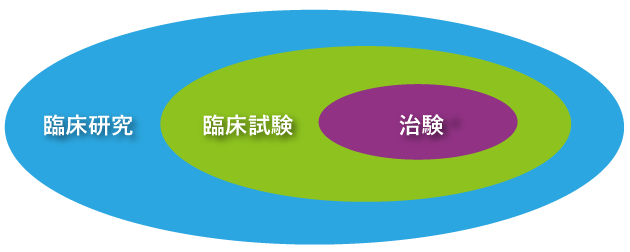
はじめに「臨床試験」、「臨床研究」、「治験」という言葉について整理してみましょう。
新しい治療法などの安全性や有効性を調べるために、人を対象として試験をする必要があります。この試験を臨床試験と言います。
「臨床研究」は、病気の解明、病気の予防・診断・治療の改善、患者の生活の質の向上などを目的として行われる、人を対象とした医学研究のすべてを指します。臨床研究には、臨床試験と治験が含まれます。(この情報は「国立がん研究センターがん情報サービス」の出典で、https://ganjoho.jp/public/dia_tre/clinical_trial/ct_qa01.html#qa179よりご覧いただけます。)
レイサマリーについて
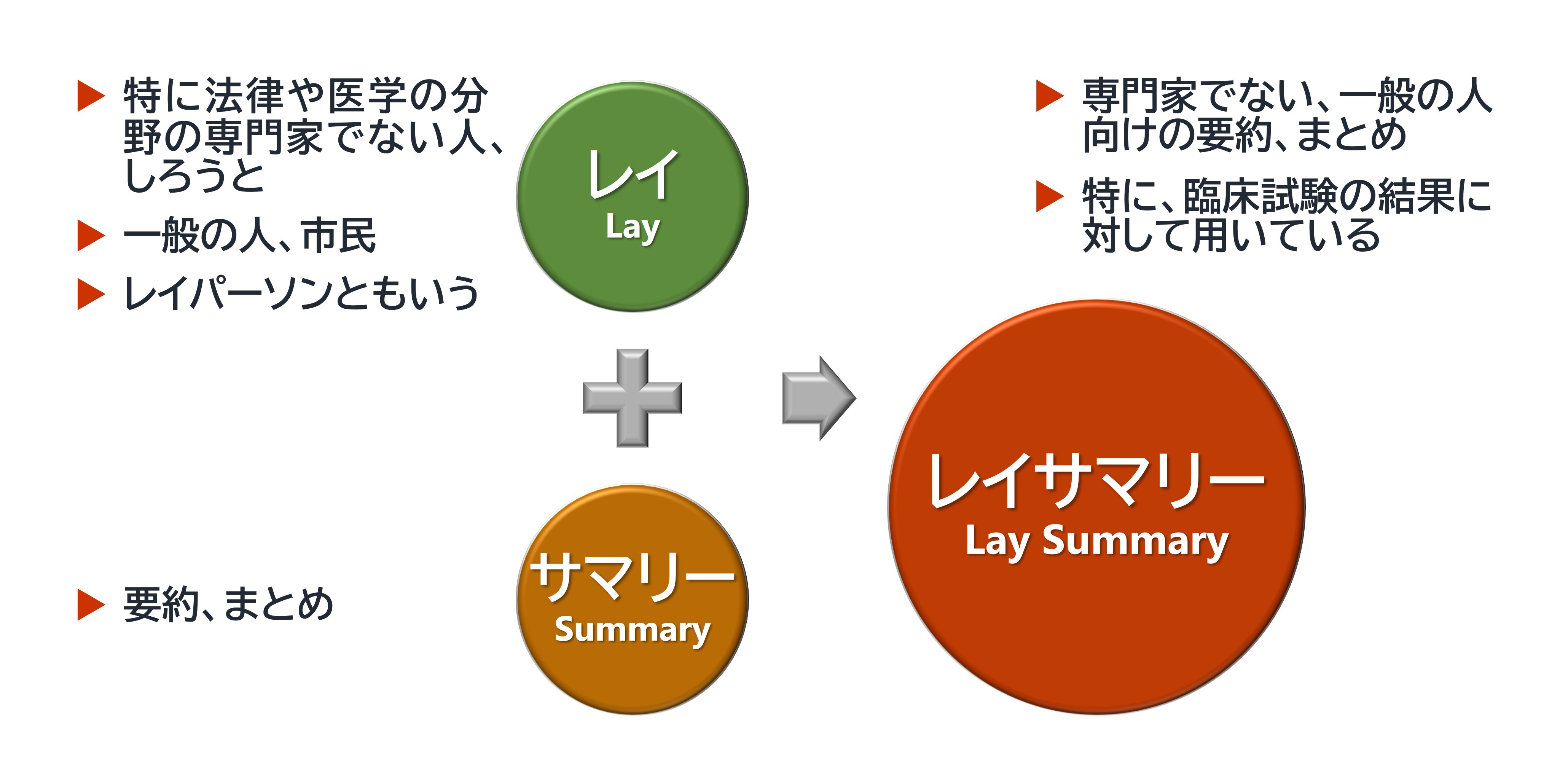
臨床試験が終了すると、多くの場合、その試験の内容や結果は医学論文として公表されます。このような論文は専門家のために書かれるもので、患者・家族や市民のみなさんにとっては読みやすいものではありません。一方、試験の内容や結果を誰もが読んで理解できるようにまとめたものをレイサマリー(Lay Summary)と呼びます。
欧州ではすべての臨床試験に対してレイサマリーの作成が必須となっており、臨床試験参加者だけでなく誰もがレイサマリーを読むことができます。日本ではこうした制度はなく、誰もがレイサマリーを自由に見られる状況にはありませんが、2023年1月24日、厚生労働省が通知「治験に係る情報提供の取扱いについて」を発出したことで、患者・家族や市民のみなさんがレイサマリーを含む臨床試験情報にアクセスできる環境が徐々に改善されることが期待されます。
レイサマリーの作成について
「レイサマリー作成の手引き」
PPI JAPANは、レイサマリーを作成したいと考える企業・研究機関のみなさん、レイサマリーについて知りたい患者・家族や市民、医療者のみなさんに向けて、「レイサマリー作成の手引き」を作成、提供しています。
PPI JAPANはこの手引きを参考にレイサマリーが多くの臨床試験で作成されることで、様々な立場の人々へのメリットや価値につながると考えています。

お読みいただいた際、何かお気づきの点がありましたら、是非、共有ください。この手引きをよりよくしていくため、様々な立場の方からのコメントをお待ちしています。この手引きを参考に臨床試験のレイサマリーを作成された場合、差し支えない範囲でその事例を共有いただけるとありがたいです。
「レイサマリー作成の手引き」の歩み
PPI JAPANは、患者・家族や市民のみなさんが臨床試験の計画や実施状況はもちろん、結果についても知る権利があると考えています。そこで欧州では一般的となっているレイサマリーに目を向け、日本での周知・普及の第一歩のために2022年6月、ワーキンググループを設置しました。この活動として、欧州のグッド・レイサマリー・プラクティス(Good Lay Summary Practice:GLSP)を基準に、日本の実態に合わせたレイサマリー作成の手引き(第1版)を作成しました。
手引きの作成では、まず実態把握と事例分析によりレイサマリーへの理解を深め、草案を作成しました。草案段階では、企業、患者団体、規制当局、アカデミアなど様々な立場の方との勉強会やワークショップを通じ意見をいただきました。「レイサマリー作成の手引き」(第1版)は、産患官学共創の結果、完成しました。本手引きの作成にあたりご尽力いただいた関係各位に厚く御礼を申し上げます。
PPI JAPANは、今後、この手引きをもとに様々な学習や議論の場を設けていきます。当団体主催のイベントや学会等での講演につきましては、このホームページ上でも案内します。
お問い合わせ
お問合せ、ご意見やご要望はこちらからお願いいたします。なお、回答までにお時間をいただくこともあるかと思いますので、その点ご了解ください。
本作成の手引きを学術研究等の参考として活用いただく場合は適切に引用の記載をお願いします。文書内容の転載をご希望される場合は許諾を依頼ください。